Việt Nam ngừng sử dụng vắc xin 5 trong 1
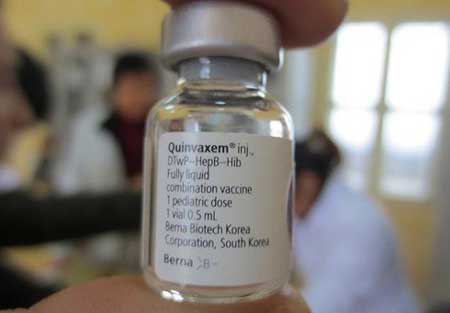
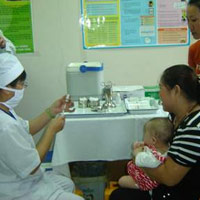
Cục Quản lý Dược (Bộ Y tế) đã ra công văn khẩn yêu cầu tạm ngừng việc sử dụng vắc xin “5 trong 1” Quinvaxem nhằm “đảm bảo an toàn cho người sử dụng”.
Chiều ngày 4/5, Cục Quản lý Dược đã ra công văn khẩn yêu cầu Sở Y tế, trung tâm y tế dự phòng các tỉnh, thành trong cả nước tạm ngừng việc sử dụng loại vắc xin này trong chương trình tiêm chủng mở rộng.
Cũng theo thông báo này, Văn phòng đại diện Công ty Berna Biotech Korea Corporation tại Việt Nam (công ty sản xuất vắc xin này) phối hợp với đơn vị nhập khẩu, phân phối phải gửi thông báo tạm ngừng sử dụng tới các nhà phân phối, đơn vị sử dụng.
Đồng thời, Cục Quản lý Dược yêu cầu báo cáo về tình hình nhập khẩu, quá trình phân phối và sử dụng vắc xin Quinvaxem inj về Cục Quản lý Dược và Cục Y tế dự phòng trước ngày 15/5.
Đây là vắc-xin có giá thành thấp (gần 100.000 đồng/liều), hiện đang sử dụng ở 90 quốc gia
Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, y tế các ngành, Ban quản lý Dự án tiêm chủng mở rộng và các trung tâm y tế dự phòng tỉnh, thành phố thông báo cho các cơ sở kinh doanh, sử dụng vắc xin tạm ngừng sử dụng vắc xin Quinvaxem inj.
Quyết định trên của Cục Quản lý Dược được cho là dựa trên “kết luận của Hội đồng tư vấn sử dụng vắc xin, sinh phẩm y tế” đưa ra từ cuối tháng 4/2013.
Trước đó, từ đầu năm 2013 liên tiếp xảy ra các vụ tai biến sau khi tiêm vắc xin này tại: Nghệ An, Lâm Đồng, Hải Dương... Gần đây nhất, ngày 19/3 Viện Pasteur TPHCM đã quyết định tạm ngưng sử dụng lô vắc xin 5 trong 1 sau khi có một trường hợp tử vong và tám trường hợp khác phải vào viện theo dõi.
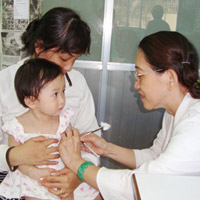
Vắc xin “5 trong 1” Quinvaxem được đưa vào chương trình quốc gia tiêm chủng mở rộng từ tháng 6/2010, tiêm cho trẻ 2, 3 và 4 tháng tuổi. Vắc-xin này do Liên minh Toàn cầu về vắc xin và tiêm chủng (GAVI) tài trợ cho Việt Nam đến hết năm 2015. Trong hơn 2 năm qua, Việt Nam nhập về gần 15 triệu liều và đã sử dụng hơn 11 triệu liều.