Đình chỉ lưu hành vắc xin phòng bệnh dại kém chất lượng
Thanh tra của Tổ chức y tế thế giới (WHO) khẳng định, vắc xin phòng bệnh dại do Công ty Cadila Healthcare sản xuất không đáp ứng các nguyên tắc tiêu chuẩn GMP.
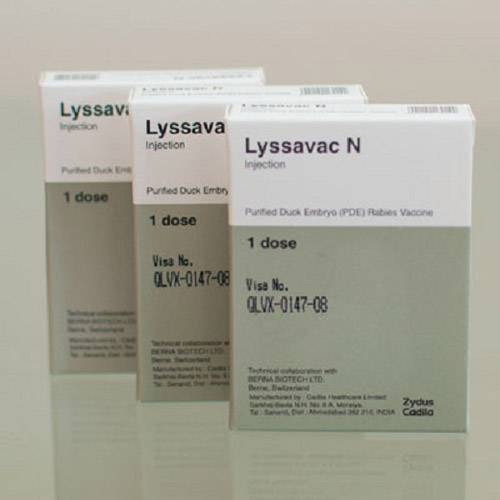
Vắc xin phòng bệnh dại Lyssavac N bị đình chỉ lưu hành do không đảm bảo các yêu cầu về chất lượng
Ngày 21.3.2016, Sở Y tế Hà Nội có văn bản 1161/SYT-NVD thông báo đình chỉ lưu hành vắc xin phòng bệnh dại Lyssavac N. Đây là vắc xin do Công ty Cadila Healthcare Ltd., India sản xuất, Công ty Cổ phần xuất nhập khẩu y tế TP. Hồ Chí Minh nhập khẩu, Công ty Cổ phần vắc xin và sinh phẩm Nam Hưng Việt ủy thác nhập khẩu.
Trước đó, vào ngày 26 đến 30.10.2015, đoàn thanh tra của Tổ chức Y tế thế giới (WHO) đã tiến hành kiểm tra tại Công ty Cadila Healthcare Ltd., India và khẳng định, cơ sở sản xuất không đáp ứng các nguyên tắc, tiêu chuẩn GMP.
Các lô vắc xin Lyssavac N bị đình chỉ lưu hành và thu hồi là RO 107, hạn sử dụng tháng 7.2017; RO 114, hạn sử dụng tháng 6.2017; RO 117, hạn sử dụng tháng 6.2017.
Sở Y tế Hà Nội yêu cầu Trung tâm y tế Dự phòng Hà Nội, Trung tâm y tế các quận, huyện, thị xã, các cơ sở y tế trên địa bàn khẩn trương rà soát, thu hồi vắc xin Lyssavac N có các số lô nêu trên và báo cáo kết quả thực hiện về Sở Y tế trước ngày 31.3.2016.